Por una parte se produce en determinados momentos del año, pues sobre todo se asocia con el champagne; solo afecta a partes pequeñas del preciado líquido y por muy poco tiempo; el proceso se produce en momentos festivos que una vez finalizados se dejan en mera anécdota; no implica ningún problema de salud para las personas y tampoco implica algún tipo de cuestión económica para ninguna empresa de importancia. Todo esto explica que no haya habido a lo largo de mucho tiempo suficiente interés en la ciencia por realizar experimentos que aclarasen el asunto definitivamente. Todo fue así hasta que en 1995 el Centro Interprofesional de Vinos de Champagne (CIVC) –obviamente de Champagne, Francia- estudió el asunto desde el rigor científico llegando a resultados definitivos [1].
Perdone el lector o lectora que no adelante ya esos resultados, pero es una forma de obligarles a que continúen leyendo.
LA DISOLUCIÓN DEL GAS CARBÓNICO EN AUGA
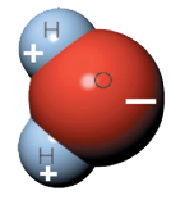 De lo que estamos hablando para empezar es de la disolución del dióxido de carbono –CO2– en agua. Es verdad que las bebidas en cuestión llevan otras substancias disueltas, pero en la mayoría estamos hablando como mínimo de un 90% de agua. El líquido elemento está formado por moléculas de agua que presentan una separación de cargas eléctricas en su volumen debido a las propiedades químicas del Oxígeno y el Hidrógeno. Decimos que la molécula de agua presenta polos eléctricos (en la figura, la parte derecha es negativa y la izquierda es positiva), o dicho de forma más correcta: es una molécula polar. Esto provoca que las moléculas se atraigan con suficiente fuerza para que a temperatura ambiente formen un sistema líquido hasta los 100 ºC. Lo que acabamos de comentar es algo extraordinario, que necesita de una explicación más detallada, pero esto es tema para otro artículo en el futuro.
De lo que estamos hablando para empezar es de la disolución del dióxido de carbono –CO2– en agua. Es verdad que las bebidas en cuestión llevan otras substancias disueltas, pero en la mayoría estamos hablando como mínimo de un 90% de agua. El líquido elemento está formado por moléculas de agua que presentan una separación de cargas eléctricas en su volumen debido a las propiedades químicas del Oxígeno y el Hidrógeno. Decimos que la molécula de agua presenta polos eléctricos (en la figura, la parte derecha es negativa y la izquierda es positiva), o dicho de forma más correcta: es una molécula polar. Esto provoca que las moléculas se atraigan con suficiente fuerza para que a temperatura ambiente formen un sistema líquido hasta los 100 ºC. Lo que acabamos de comentar es algo extraordinario, que necesita de una explicación más detallada, pero esto es tema para otro artículo en el futuro.
 Sin embargo, el dióxido de carbono no presenta esa separación de cargas y por tanto se trata de una molécula sin polos, es decir apolar. No hay razón para que sus moléculas se atraigan y esta es la razón de que el CO2 sea gas a temperaturas por encima de -80ºC .
Sin embargo, el dióxido de carbono no presenta esa separación de cargas y por tanto se trata de una molécula sin polos, es decir apolar. No hay razón para que sus moléculas se atraigan y esta es la razón de que el CO2 sea gas a temperaturas por encima de -80ºC .
Por tanto, es fácil entender que el agua y el dióxido de carbono no se “llevan muy bien”. ¿Por qué razón las moléculas de agua se van a separar para unirse con las de dióxido de carbono?
Por cierto, esta argumentación puede generalizarse para explicar porque unas substancias se disuelven mejor en agua que otras, o por qué en general hay substancias que se mezclan bien y otras que se mezclan mal, o no se mezclan (agua y aceite).